
2016年12月26日讯 /生物谷BIOON/ --由百健(Biogen)与Ionis制药公司合作开发的一款罕见病治疗药物Spinraza(nusinersen)近日在美国监管方面传来喜讯。美国食品和药物管理局(FDA)已批准Spinraza用于脊髓性肌萎缩症(SMA)儿科患者和成人患者的治疗。Spinraza是一种反义寡核苷酸(ASO),旨在改变SMN2基因的剪接,以增加全功能性SMN蛋白的生产;在临床研究中,Spinraza治疗显著提高了SMA患者的运动机能。此次批准,使Spinraza成为全球首个也是唯一一个获批治疗脊髓性肌萎缩症(SMA)的药物。百健已计划在一周内将Spinraza推向美国市场。
值得一提的是,FDA自收到Spinraza监管文件之后的3个月内便加速批准Spinraza,突显了该领域迫切的严重未满足的巨大医疗需求。在美国和欧盟,Spinraza均被授予孤儿药地位;在美国,Spinraza还获得了快车道地位和优先审查资格;在欧盟也收获了加速审批资格。
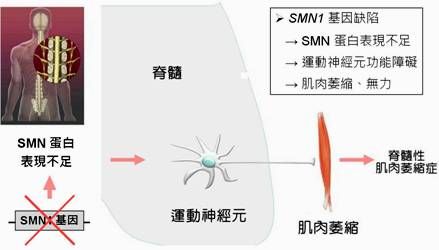
SMA是一种会导致肌肉无力和萎缩的运动神经元性疾病,该病属于基因缺陷导致的常染色体隐性遗传病,对患者周身上下的肌肉都会造成侵害,患者主要表现为全身肌肉萎缩无力,身体逐渐丧失各种运动功能,甚至是呼吸和吞咽。SMA是2岁以下婴幼儿群体中的头号遗传病杀手,该病是一种相对常见的“罕见病”,在新生儿中的患病率为1:6000-1:10000。
据相关报道,目前中国国内脊髓性肌萎缩症(SMA)患者人数大约3-5万人。
Spinraza的获批,是基于多个临床研究的积极数据,这些研究涉及超过170例SMA患者。在婴幼儿期发病的SMA患者中开展的一项临床研究ENDEAR的数据显示,与未接受治疗的患者相比,接受Spinraza治疗的患者在运动机能方面表现出统计学意义的显著改善,并且有显著更高的患者存活率。该研究中,Spinraza表现出良好的安全性。
今年11月,百健和Ionis公布了在晚发型SMA患者中开展的III期临床研究CHERISH的数据。该研究为期15个月,纳入了126例非卧床的晚发型脊髓性肌萎缩症(SMA)患者,这些患者的症状和体征超过6个月,年龄在2-12岁之间。该研究显示,患者接受Spinraza治疗15个月后,Hammersmith运动功能评分量表(HFMSE)平均提高4.0分,而未接受治疗的患者平均降低1.9分,数据具有统计学显著差异,达到了研究的主要终点。在临床治疗中,HFMSE提高3分及以上被认为具有临床意义。